Возьмите в руки средство для снятия лака (кажется, это вещество есть у каждого в доме или, как минимум, хоть раз попадалось на глаза). На большинстве из них в настоящее время виднеется яркая надпись: без ацетона. Но далеко не всем известно хоть что-нибудь, кроме названия, о химическом веществе под названием ацетон.
Что же такое ацетон?
Химическая формула ацетона предельно проста: C 3 H 6 O. Если человек был внимателен на уроках химии, то, возможно, он даже помнит класс химических соединений, к которому относится данное вещество, а именно — кетон. Или же внимательный в прошлом ученик школы может помнить не только хим. формулу ацетона и класс соединения, а еще и структурную формулу, которая представлена на рисунке ниже.
Помимо структуры, формула ацетона отражает и его общепринятое по номенклатуре ИЮПАК название: пропанон-2. Хотя вновь стоит отметить, что некоторые читатели, возможно, даже помнят правила названия химических веществ со школьной скамьи.
А если говорить о том, что кроется под формулой ацетона в реальной жизни, а не на картинке с формулой или структурой? Ацетон при нормальных условиях представляет собой летучую жидкость без цвета, но с характерным резким запахом. Можно быть точно уверенным в том, что с запахом ацетона знаком почти каждый человек.
История открытия
Как и любое химическое вещество, ацетон имеет своего «родителя», то есть человека, который впервые обнаружил данное вещество и написал первую страницу в истории химического соединения. «Родителем» ацетона является Андреас Либавий (фото представлено ниже), который впервые выявил его во время сухой перегонки ацетата свинца. Произошло это ни много ни мало чуть больше, чем 400 лет назад: в 1595 году! Однако это не могло являться полноценным открытием, ведь химический состав, природу, формулу ацетона смогли установить лишь 300 лет спустя: только в 1832 году ответы на данные вопросы смогли найти Жан-Батист Дюма и Юстус фон Либих.
Однако это не могло являться полноценным открытием, ведь химический состав, природу, формулу ацетона смогли установить лишь 300 лет спустя: только в 1832 году ответы на данные вопросы смогли найти Жан-Батист Дюма и Юстус фон Либих.
Методом получения ацетона вплоть до 1914 года служил процесс коксования древесины. Но в период Первой мировой войны на ацетон очень повысился спрос, так как он стал выступать в роли важнейшего компонента производства бездымного пороха. Именно данный факт послужил толчком для создания более изящных способов производства данного соединения. Сложно поверить, но начали получать ацетон из кукурузы, а открытие данного способа в поддержку военных нужд принадлежит Хаиму Вейцману, ученому-химику из Израиля.
Применение ацетона
Мы установили «официальное» название, некоторые физические свойства и формулу ацетона, производство которого в мире составляет около 7 миллионов тонн в год (и это данные за 2013 год, а объемы производства только растут). Но что можно сказать о его роли в жизнедеятельности человечества?
Как уже было сказано выше, данное вещество является летучей жидкостью, что значительно затрудняет его использование в производстве. О каком использовании идет речь? Дело в том, что ацетон применяется в качестве растворителя многих веществ. Однако его повышенная испаряемость зачастую мешает пользоваться им в чистом виде, для чего состав данного растворителя на производстве намеренно меняют. В пищевой промышленности ацетон играет важную роль, так как не отличается столь сильной токсичностью (в отличие от большинства других растворителей). Все хоть раз сталкивались с банальной жидкостью для снятия лака на основе ацетона (хоть современное общество старается и искоренить его из состава). Также ацетон нередко используют для обезжиривания различного рода поверхностей. Важно отметить и то, что широко распространено данное вещество в фармацевтических синтезах, в синтезах эпоксидных смол, поликарбонатов и даже взрывчатых веществ!
В пищевой промышленности ацетон играет важную роль, так как не отличается столь сильной токсичностью (в отличие от большинства других растворителей). Все хоть раз сталкивались с банальной жидкостью для снятия лака на основе ацетона (хоть современное общество старается и искоренить его из состава). Также ацетон нередко используют для обезжиривания различного рода поверхностей. Важно отметить и то, что широко распространено данное вещество в фармацевтических синтезах, в синтезах эпоксидных смол, поликарбонатов и даже взрывчатых веществ!
Насколько опасен ацетон для человека?
Не раз звучали слова о слабой токсичности интересующего нас вещества. Стоит же сказать более конкретно об опасности, которую представляет столь безобидная, на первый взгляд, формула ацетона для человека.
Данное вещество относится к легковоспламеняющимся и веществам 4-го класса опасности, то есть малотоксичным. Последствия попадания ацетона в глаза крайне серьезны — это либо сильное снижение зрения, либо его полная утрата, так как ацетон вызывает сильный химический ожог слизистой, а заживление оставляет рубец на сетчатке. Немедленное промывание глаз большим количеством чистой воды поможет частично снизить вред зрению.
Последствия попадания ацетона в глаза крайне серьезны — это либо сильное снижение зрения, либо его полная утрата, так как ацетон вызывает сильный химический ожог слизистой, а заживление оставляет рубец на сетчатке. Немедленное промывание глаз большим количеством чистой воды поможет частично снизить вред зрению.
Попадание ацетона в организм пероральным путем вызывает следующие последствия: потеря сознания через несколько минут, периодичные остановки дыхания, возможно снижение артериального давления, тошнота и рвота, боли в животе, отек слизистых рта, пищевода и желудка, одышка, учащенное сердцебиение, а также галлюцинации.
Ингаляционное отравление газообразным ацетоном проявляется почти аналогично вышеописанному. Очевидным различием выступает отек дыхательных путей, а не пищеварительного тракта. Отеку могут быть подвержены также глаза при контакте с окружающей средой с распространенным газом.
Ожогов кожи при попадании ацетона чаще всего не наблюдается, что обусловлено высокой летучестью вещества. Однако все же известны случаи получения ожогов 1-ой и 2-ой степени.
Интересное производное ацетона: знакомьтесь, ацетоксим
Помимо свойств и формулы ацетона как такового, стоит поближе узнать и его ближайших «родственников». Например, познакомимся с таким веществом, как ацетоксим.
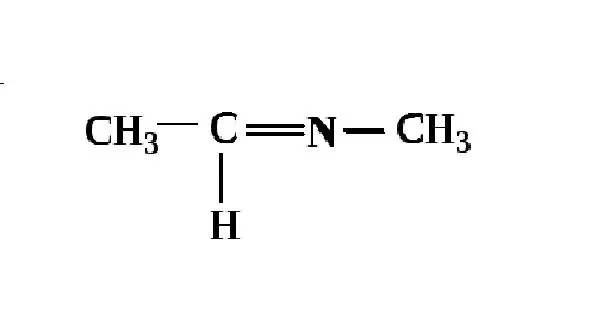
Ацетоксим — это производное ацетона. Формула оксима ацетона ненамного сложнее формулы так хорошо знакомого нам пропанона-2: C 3 H 7 NO. Пространственная структура представлена на рисунке ниже.
 Один из возможных способов получения ацетоксима — это взаимодействие ацетона с гидроксиламином.
Один из возможных способов получения ацетоксима — это взаимодействие ацетона с гидроксиламином.
Применение оксимов
Говоря о таком классе органических соединений, как оксимы, необходимо отметить сферу их использования в современном мире. Сами по себе оксимы являются твердыми веществами, но легкоплавкими, то есть с низкими температурами плавления.
Различные оксимы имеют, соответственно, различное применение. Так, некоторые из них необходимы в производстве капролактама, другие используются в аналитической химии, где помогает в обнаружении и количественном определении никеля (так как результатом взаимодействия является вещество красного цвета).
Отдельный класс оксимов используется как лекарственное средство при отравлениях фосорорганическими соединениями.